2024年2月19日
国立大学法人 筑波大学
紅色硫黄細菌が行う光合成では、光エネルギーを化学エネルギーに変換します。このとき、通常とは異なり、カルシウムが少ない環境でも光合成する種があります。クライオ電子顕微鏡により光を集めるタンパク質の構造を調べ、カルシウムが少なくても光合成ができるメカニズムを明らかにしました。
概要
光合成細菌が行う光合成は、酸素を発生せず、硫化水素を使って太陽光エネルギーを化学エネルギー(電子)に変換します。この役割は、タンパク質複合体であるコア光捕集反応中心複合体(LH1-RC)が担っています。中でも紅色硫黄細菌の多くは、温泉・海中といったカルシウムが豊富な環境に棲息しており、LH1-RCの立体構造では、光捕集に特化したアンテナタンパク質であるLH1にカルシウムが結合しています。しかし、カルシウム含量の少ない軟水や欠乏状態の水中でも増殖できる常温菌のモデル種アロクロマチウム・ビノサムについては、これまで、光合成にカルシウムは関与していないと考えられており、そのメカニズムは謎につつまれていました。
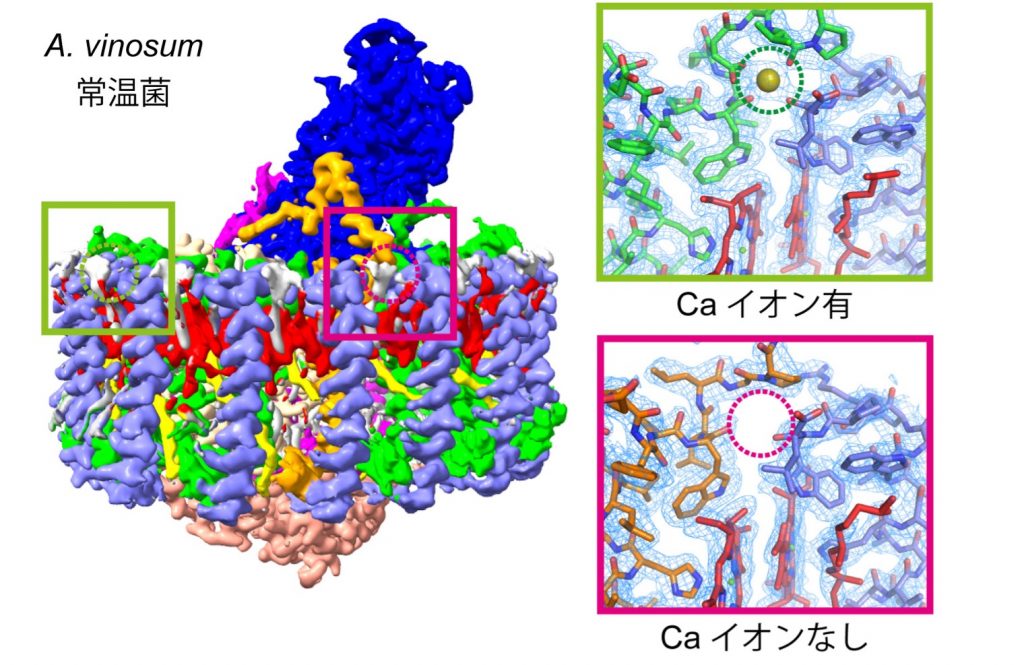
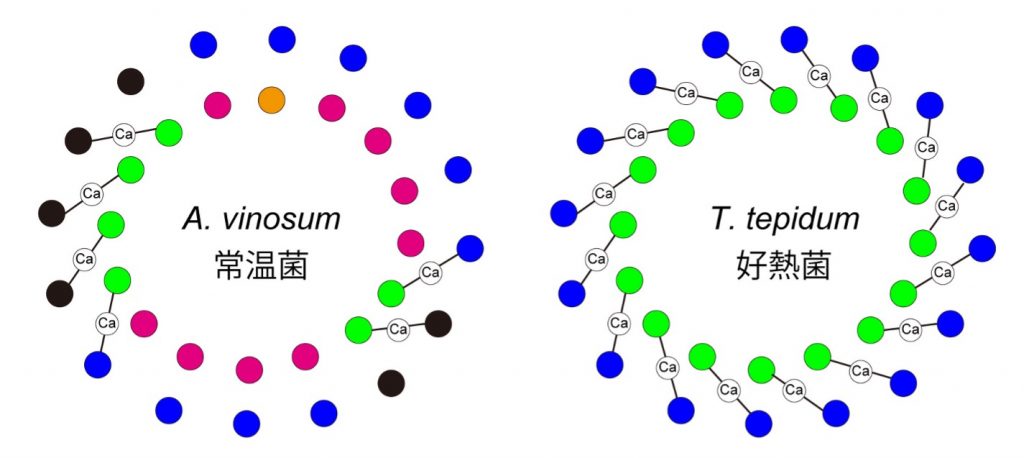
そこで、クライオ電子顕微鏡を用いて、本種由来のLH1-RCをアミノ酸が可視化できるレベルで観察したところ、LH1サブユニットのうち特定の6か所にのみ、カルシウムが結合していました。近縁種の好熱菌サーモクロマチウム・テピダムでは、全てのLH1サブユニット16か所にカルシウムが結合しており、アミノ酸配列のパターンに応じてカルシウムが結合できるかどうかが決まっていることが分かりました。このことから、本種は進化の過程で軟水中の微量カルシウムを結合して光合成を行うようなメカニズムを採用し、熱安定性を向上させていることが示唆されました。
本研究成果は、多くの生物にとって有毒な硫化水素を硫黄へ分解しつつ、淡水中でも光合成を行える種の、高効率な太陽光エネルギー利用への貢献や環境保全への活用が期待されます。
研究代表者
筑波大学 計算科学研究センター
谷 一寿 教授
研究の背景
光合成細菌は、植物やシアノバクテリアと異なり、光合成時に酸素を発生しないものの、非常に高い効率で太陽光エネルギーを化学エネルギー(電子)へ変換できるように進化してきました。どの光合成細菌も、植物で利用しない近赤外領域の太陽光を利用するという点では同じ特徴を持っていますが、菌の種類ごとに棲息環境が異なり、淡水から海水、温泉まで幅広く、それぞれの環境に最適な光捕集メカニズムを有しています。
酸素非発生型の光合成細菌の光合成は、進化的に古く、酸素発生型である植物の光合成に類似している部分もありますが、効率を重視した独自の進化過程を遂げたことが分かっています。特に硫化水素を使って光合成を行う紅色硫黄細菌注1)のほとんどは、熱安定性のために生育上カルシウムが必要で、温泉や海といったミネラル豊富な水中に棲息しますが、ごく一部の種ではカルシウム含量の少ない軟水にも棲息しています。このような種では、光を電子に変換するタンパク質複合体であるコア光捕集反応中心複合体(LH1-RC)注2)が、独特の進化をしていますが、その立体構造とカルシウムイオンの関係性は不明な部分が多く、カルシウムが要求されない生育環境で、高効率かつ安定的な光合成を行える仕組みは謎に包まれていました。
今後の展開
本研究で行った、常温菌である紅色硫黄細菌と好熱菌のLH1-RCの比較結果から、紅色硫黄細菌の高温耐性へ向けた遺伝子改変・導入を行うことで、その生物工学的な利用における効率・安定性が向上すると考えられます。また、硫化水素を含む排水処理といった環境保全にまで広く活用できると期待されます。
参考図

用語解説
注1)紅色硫黄細菌
光合成細菌の仲間で、含まれるカロテノイドの種類により赤、褐色などに見える。ほとんどが嫌気性で硫黄泉、湖などの硫化水素が溜まった酸素のない環境を好んで棲息している。植物などとは異なり、光合成時には水ではなく硫化水素を使うため、酸素を発生しない。カルシウムイオンは、熱安定性に関連しているものの、硫黄代謝に直接の関連性はないため、長らく常温菌のA. vinosumは光合成にカルシウムイオンが不要だと考えられてきた。
注2)コア光捕集反応中心複合体(LH1-RC)
光エネルギーをアンテナタンパク質(LH1)で効率的に捕集し、反応中心(RC)へ伝え、光から電子への変換を行い、キノン分子により電子を伝達するタンパク質複合体。
注3)クライオ電子顕微鏡(Cryo-EM)
生体の高分子構造を立体的に解析できる手法の一種。本研究では、筑波大学生存ダイナミクスセンターのCRYO-ARM300IIと、沖縄科学技術大学院大学のTitan Krios G1を使用した。
注4)LH1サブユニット
光を集めるためのアンテナタンパク質LH1は、通常、α鎖とβ鎖と呼ばれる2種類の膜タンパク質から構成される。これらは、14~17ペアで、隙間なくリング状に並ぶことが多い。このリング状構造では、内側にα鎖が、外側にβ鎖が配列される。
注5)アイソフォーム
単一の遺伝子あるいは遺伝子ファミリーに由来している類似のタンパク質。互いに同じ機能である場合もあるが、全く異なることもある。LH1サブニットでは、α鎖とβ鎖のそれぞれが複数のアイソフォームで構成されることがある。T.tepidumは、α鎖とβ鎖ともに1種類ずつで、アイソフォームはないが、A. vinosumは、α鎖3種類とβ鎖2種類のアイソフォームが存在する。
研究資金
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)JP21am0101118、 JP21am0101116、JP22am121004、科研費(JP20H05086, and JP20H02856)等の助成を受けて実施されました。
【題 名】 High-Resolution Structure and Biochemical Properties of the LH1–RC Photocomplex from the Model Purple Sulfur Bacterium, Allochromatium vinosum.
(紅色硫黄細菌のモデル種アロクロマチウム・ビノサム由来光捕集反応中心複合体の高分解能構造と生化学的特性)
【著者名】 Kazutoshi Tani, Ryo Kanno, Ayaka Harada, Yuki Kobayashi, Akane Minamino, Shinji Takenaka, Natsuki Nakamura, Xuan-Cheng Ji, Endang R. Purba, Malgorzata Hall, Long-Jiang Yu, Michael T. Madigan, Akira Mizoguchi, Kenji Iwasaki, Bruno M. Humbel, Yukihiro Kimura & Zheng-Yu Wang-Otomo
【掲載誌】 Communications Biology
【掲載日】 2024年2月12日
【DOI】 10.1038/s42003-024-05863-w
