計算メディカルサイエンス事業部
事業目的
医療に関わる新技術の研究開発において、大学などの教育・研究機関の工学系研究者と民間企業の医療関係者が連携する「医工連携」や理学系研究者を加えた「医理工連携」がこれまで行われてきました。昨今、計算科学が急速に発展し、物理学や生命科学分野で高精度な計算技術が開発され、理論、実験にならぶ研究手法として確立されています。また、データ基盤分野や情報メディア分野では、ビッグデータサイエンスや機械学習の手法も目覚ましい発展を見せています。
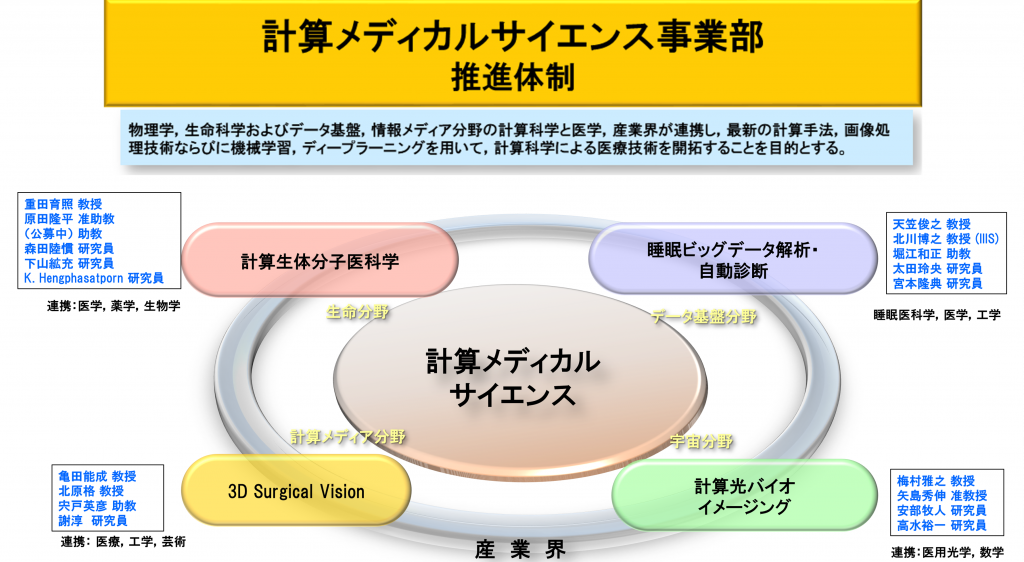
筑波大学計算科学研究センターでは、これらの最先端の計算科学を医学と連携させる新たな取組みとして「医計連携」を創出する「計算メディカルサイエンス事業」を推進します。本事業は、物理学、生命科学およびデータ基盤,情報メディア分野の計算科学と医学、産業界が連携し、最新の計算手法、画像処理技術ならびに機械学習、ディープラーニングを用いて、計算科学による医療技術を開拓することを目的とします。この目的のため、(1) 計算生体分子医科学、(2) 睡眠ビッグデータ解析・自動診断、(3) 3D Surgical Vision、(4) 計算光バイオイメージングのプロジェクトチームを設置し、学内外の連携とチーム間連携を図り研究を推進します。
事業部長:梅村 雅之 教授
プロジェクトチーム
計算メディカルサイエンス イントロダクション
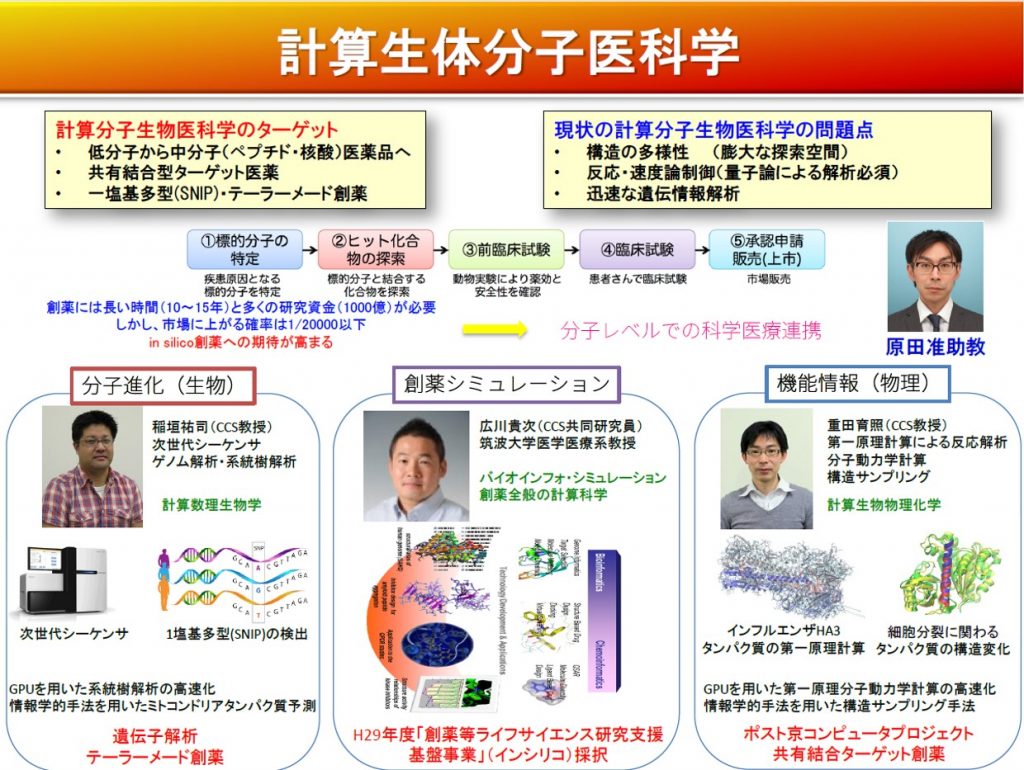
計算生体分子医科学
【実施体制】
担当者:
重田 育照(筑波大学 計算科学研究センター 生命科学研究部門 教授)
原田 隆平(筑波大学 計算科学研究センター 生命科学研究部門 准教授)
堀 優太 (筑波大学 計算科学研究センター 生命科学研究部門 助教)
Kowit Hengphasatporn(筑波大学 計算科学研究センター 生命科学研究部門 助教)
森田 陸離(筑波大学 計算科学研究センター 生命科学研究部門 研究員)
下山 紘充(筑波大学 計算科学研究センター 生命科学研究部門 研究員)
協力者:
広川 貴次(筑波大学医学医療系 教授)
吉野 龍之(筑波大学医学医療系 助教)
稲垣 祐司(筑波大学 計算科学研究センター 生命科学研究部門 教授)
【背景】
生体内のタンパク質を構成する物質は20種類のL型アミノ酸(や補因子)であり,基本的にL型アミノ酸の1次元鎖が特異的かつ動的な3次元立体構造,さらにはその複合体である4次構造を形成することで,タンパク質(集合体)はその機能を発現する。従来の医薬品開発では,ある特定の標的に対して高い選択性と結合能を併せ持つ副作用の少ない小分子や,様々なタンパク質に特異に結合する抗体の開発を目指してきた。それらをサポートするため,近年,上市に10年・1薬剤あたり1000億円にもなるコストを減少できるものと期待されてin silico技術の高度化が行われてきた。小分子に関しては,様々なリード化合物に対して網羅的に官能基を導入し,ドッキングシミュレーションやその構造をもとにした分子動力学計算を実行する(またその逆過程も繰り返し行う)ことで,低分子化合物をスクリーニングすることが可能となっている。また後者に対しても,計算機シミュレーションによる結合能の評価や耐熱性・高安定性抗体の分子設計がなされてきている。しかし,様々な試みにもかかわらず,実用化されたケースはそれほど多くない。
【重要性・発展性】
近年,環状ペプチドやD型アミノ酸などの,非天然・非タンパク質性ペプチドなどの中規模な分子に再度注目が集まっている。ペプトド創薬自体は古くから研究されてきたものの,膜透過性や安定性(ペプチダーゼによる分解)に難があった。一方,環状ペプチドやDアミノ酸などはペプチダーゼ分解抵抗性があり,また,特に前者は膜透過性に優れるなど,従来のペプチド創薬での問題点のいくつかを克服している。したがって,これらは小分子と抗体の利点を併せ持ち,またその欠点を克服しうる新たな創薬シーズとして,現在大きな注目を集めている。これらの中規模な分子は化学合成(一部は生合成)によって精密合成可能であるが,その最適な反応経路は明らかになっていない。また,このような中規模分子が,どのように薬理活性をもつのかは不明である。
【実施計画】
第一原理計算を用いた反応経路解析や,分子動力学計算を用いた基質-タンパク質結合過程の解析の研究を行い,中規模分子をターゲットとした創薬を行う。また,計算科学研究センターのスーパーコンピュータを活用した創薬支援のためのプログラム開発や,その応用計算を行う。クラスタリング法・データ同化技術を用い,低解像度の実験構造を再現する分子動力学計算技術により,計算機上において原子レベルの構造を再構築する方法を確立し,ターゲット創薬の結合状態の解析法を確立する。開発した方法を用いて,環状ペプチドやD型ペプチドと標的タンパク質の結合部位の特異的相互作用を特定する応用研究を実行するとともに,それらの合成経路を第一原理計算で解析する。また,生合成経路を介した創薬の可能性を検討するため,発現系の大規模遺伝子解析などのバイオインフォマティクス技術も併用する。以上のようにプレシジョンメディスンに対する包括的な研究法を確立し,研究領域を開拓する。
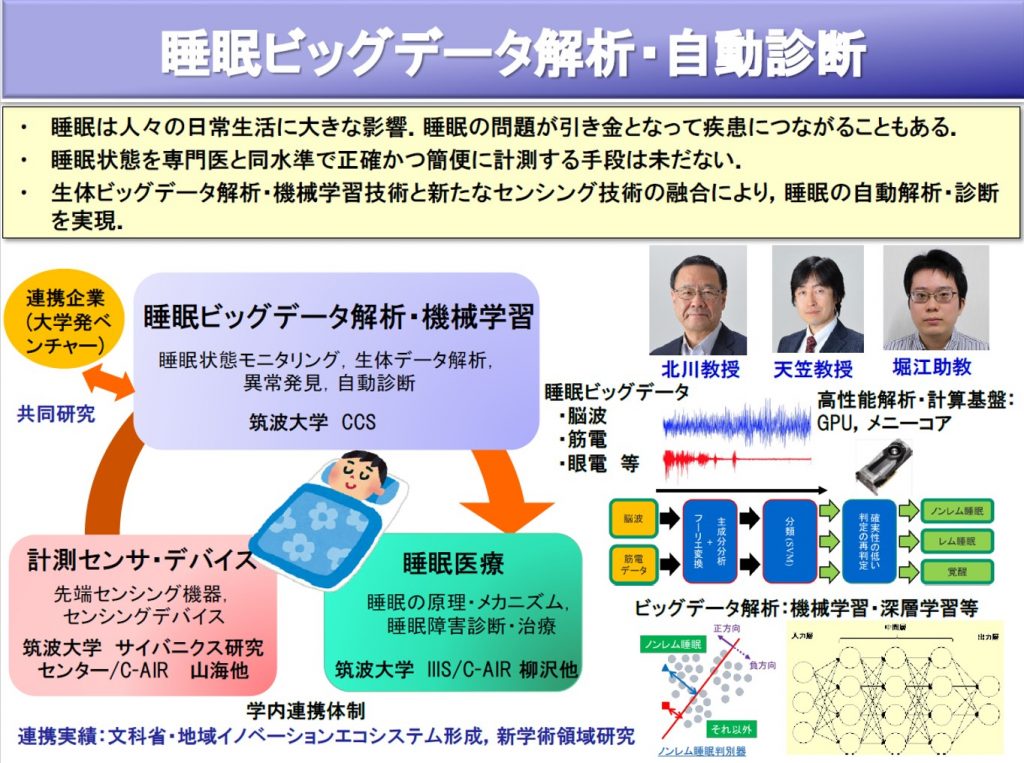
睡眠ビッグデータ解析・自動診断
【実施体制】
担当者:
天笠 俊之(筑波大学 計算科学研究センター 計算情報学研究部門 教授,C-AIR兼務)
北川 博之(筑波大学 国際統合睡眠医科学研究機構 (IIIS) 教授)
堀江 和正(筑波大学 計算科学研究センター 計算情報学研究部門 助教)
協力者:
柳沢 正史(筑波大学 国際統合睡眠医科学研究機構 (IIIS) 教授,C-AIR兼務)他
山海 嘉之(筑波大学 システム情報系・サイバニクス研究センター 教授,C-AIR兼務)他
【背景】
睡眠は人々の日常生活に大きな影響を与え,睡眠の問題が引き金となって様々な疾患につながることも知られている。しかし,睡眠に関する多くが科学的には未だ解明されていない。睡眠研究においては,睡眠現象を正確に計測し解析することが必要である。医学的計測方法である睡眠ポリソムノグラフィー検査(PSG)では,多数のセンサを被験者に取り付け,脳波・呼吸運動・眼球運動等の多様な睡眠データを一晩中連続して取得する。しかし,被験者の負担やコストが大きく,長期間にわたる計測は不可能である。また,取得したデータの分析は専門家のマニュアル診断によっており,大規模なデータを対象に分析することは不可能である。一方,近年の睡眠に対する社会的関心の高まりに対応し,スマートフォン等を用いて睡眠状態を簡易的に計測する手法等も開発されているが,現状では,専門医と同水準で正確かつ簡便に計測する手段は未だない。本研究は,睡眠ビッグデータ解析・機械学習技術と新たなセンシング技術の融合により,睡眠の自動解析・診断を実現し,さらに,睡眠ビッグデータの活用による新たな計算メディカルサイエンス分野の開拓を目指す。
【重要性・発展性】
日本人成人の約20%が慢性的な不眠を訴えているといわれており,睡眠はQOL(Quality of Life)の点から社会的に重要な研究課題である。本研究は,睡眠研究を大きく進展させるものである。長期間にわたる睡眠の自動解析・診断が可能になることにより,初めて多くの人々の睡眠を科学データに基づいて理解することが可能になる。これにより,個人ごとの睡眠特性の違い,睡眠障害やその特徴等を正確に解析することができるようになる。さらに,睡眠障害治療を含む様々な医療行為や薬品が睡眠に与える影響を分析し,その効果を定量的に判定することが可能となる。このように,本研究は睡眠現象の本質を明らかにするための基礎的研究および睡眠に関わる創薬研究等の発展に大きく寄与するものである。
【実施計画】
本研究では,(A)被験者からの脳波・筋電等の睡眠データ取得,(B)睡眠ビッグデータの自動解析,(C)解析結果の睡眠医学からの検証や睡眠医療への貢献の3点が重要となる。本チームは,既に国際統合睡眠医科学研究機構,人工知能科学センター(C-AIR),筑波大学発ベンチャー企業等と連携し,文科省・地域イノベーションエコシステム形成事業(H28-32),新学術領域研究(H27-31)等の外部研究資金を活用しつつ本研究を推進している.これまでに,大規模なマウス睡眠データやPSG等を用いて取得したヒト睡眠データを対象に,深層学習等の機械学習を用いた睡眠データ解析手法の基礎を確立している。今後は,新たに開発する簡易睡眠計測デバイスを用いて睡眠データを取得すると共に,機械学習を用いた睡眠解析手法を適用し,その自動解析・診断技術を確立する。また,自動解析・診断結果を専門医や被験者が理解することを支援するための説明機能や,睡眠ビッグデータを活用した他の睡眠研究の課題等,計算メディカルサイエンス分野の様々な研究課題に取り組む。
3D Surgical Vision
【実施体制】
担当者:
北原 格(筑波大学 計算科学研究センター 計算情報学研究部門 教授)
亀田 能成(筑波大学 計算科学研究センター 計算情報学研究部門 教授)
謝 淳(筑波大学 計算科学研究センター 計算情報学研究部門 助教)
協力者:
矢野 博明(筑波大学 システム情報系 教授)
黒田 嘉宏(筑波大学 システム情報系 教授)
小田 竜也(筑波大学 医学医療系 教授)
橋本 真治(筑波大学 医学医療系 准教授)
吉井 雄一(東京医科大学 茨城医療センター 教授)
大城 幸雄(東京医科大学 茨城医療センター 講師)
【背景】
日本人の死亡原因1位は癌であり,その治療法の第一選択は手術である。医療技術の進歩によって手術の安全性は飛躍的に向上しているものの,依然数%の患者の命が手術によって失われている。一方で,医療の高度化は習得すべき知識や技術を増大させるため,医師毎の技能のバラツキ(癌の切除治療における5年生存率の地域格差は10%以上)や外科医師数不足(教育に15年を要する)などの問題が一層深刻になることが危惧されている。これまでにもIT技術を用いたバーチャル手術に関する研究開発が行われているが,3次元計算メディア技術に基づいた外科手術の作業支援・技能教育の高度化の試みは始まったばかりである。
【重要性・発展性】
医師が術前検討で用いる3DCGシミュレーションと3次元映像処理技術に基づくオンサイトナビゲーションを統合することで,適切な施述手順や高度な医療技術の直感的な把握を可能とする3D手術ナビゲーションシステムを構築し,施述レベルの向上を可能とする。また,3次元映像処理や拡張現実(AR)提示などの基盤技術を活用することで遠隔診断・VR治療システムの実現も可能であり,医療技術の地域格差の是正への効果も期待できる。3次元センシングと画像病理診断技術を統合することで,病理診断の高度化,および,手術手技・熟達度の評価による外科医の効率的な教育の実現を目指し,外科医不足の解消を試みる。視認性の高い開腹手術だけでなく,腹腔鏡手術に対しても同様のシステムを実現することにより,より患者の身体的負担の少ない術式の実現にも取り組む。
【実施計画】
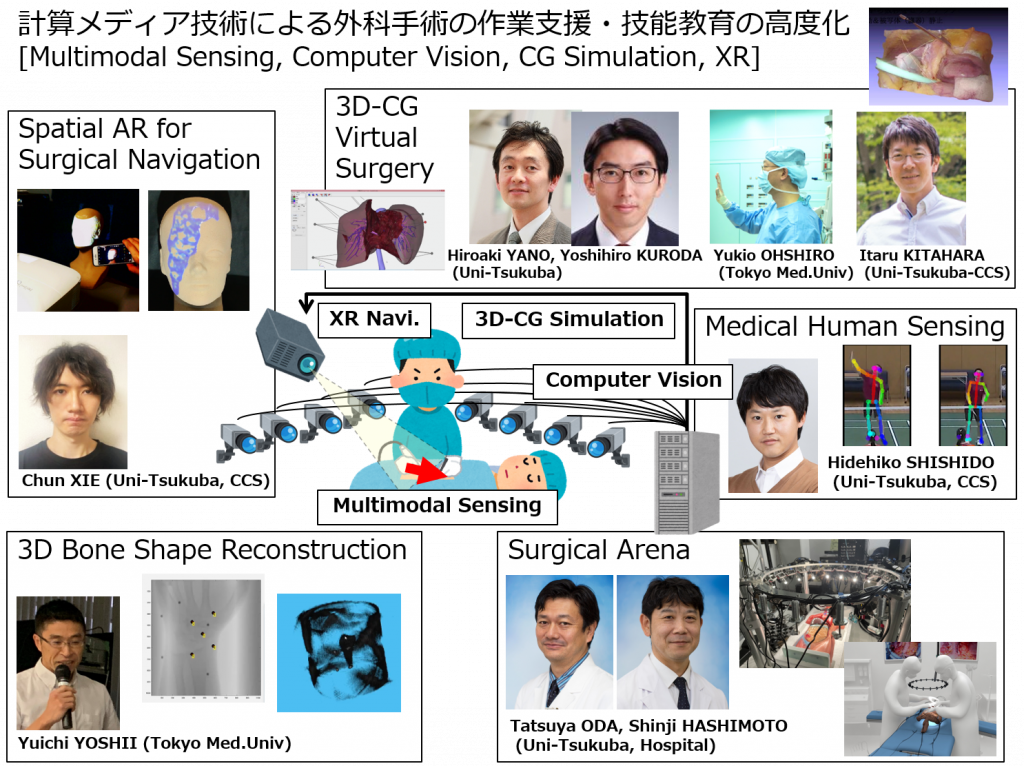
「多様なセンサによる観測」「3次元CGシミュレーション」「3次元手術映像処理(コンピュータビジョン)」「手術分析・病理診断」「XR手術ナビゲーション」の5項目において研究開発を推進する。ここでいうXRとはVR(Virtual Reality),AR(Augmented Reality: 拡張現実),MR(Mixed Reality:複合現実感)などの視覚情報メディア技術の総称である。
「多様なセンサによる観測」では,術者および開腹手術野を他方向から網羅的に観測可能な多視点映像撮影システム,腹腔鏡カメラによる体内映像システム,X線撮像装置を用いた透視映像撮影システムを,医療機器メーカと共同して実際の手術現場に導入する。「3次元手術映像処理(コンピュータビジョン)」では,術者の多視点映像を用いて手術時の動線や動作の分析処理を実施し,術時行動の適切化を実現する。また,腹腔鏡映像や複数枚のX線透視画像から臓器や骨の3次元形状を復元し,「3次元CGシミュレーション」による術前計画との照合や,3次元情報に基づく「手術分析・病理診断」について研究を進める。分析結果を術者に効率的に伝達することを目的としたプロジェクションマッピングシステムを開発し「XR手術ナビゲーション」を実現する。
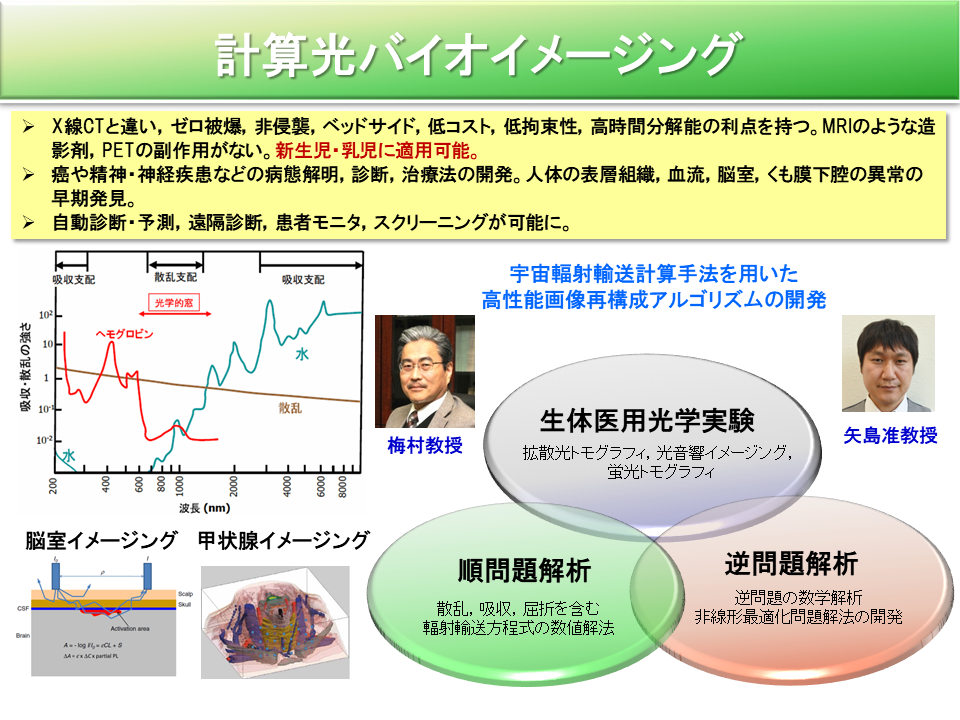
計算光バイオイメージング
【実施体制】
担当者:
梅村 雅之(筑波大学 特命教授)
矢島 秀伸(筑波大学 計算科学研究センター 宇宙物理学研究部門 准教授)
協力者:
星 詳子(浜松医科大学 光尖端医学教育研究センター 教授)
大川 晋平(浜松医科大学 光尖端医学教育研究センター 教授)
【背景】
近年,光イメージング技術の進歩は目覚ましく,生きている細胞や組織の中で生じている分子プロセスの追跡が可能になっている。現在,医療分野ではX 線CTやMRIなどのイメージング法が広く用いられており,これらは主として臓器・組織レベルの形態変化を捉えるが,被爆の危険性を伴い,大がかりな装置や特殊な計測室を必要とする。光イメージングは,分子から臓器までマルチレベルの機能ならびに形態学的情報を動的に可視化することができ,ゼロ被爆,非侵襲,ベッドサイド計測,低コスト,低拘束性,高時間分解能といった多くの利点を持つ。しかしながら,光イメージング技術を生体に適用する場合,生体が強散乱体であるため散乱光から生体局所の情報を引き出す必要があり,高度な計算科学技術が要求されることから,これまで実用化に向けての十分な研究はなされてこなかった。
【重要性・発展性】
近赤外光を用いたヒト生体光イメージングは次世代の画像診断法で,癌や精神・神経疾患などの病態解明,人体の表層組織,血流,脳室,くも膜下腔の異常の早期発見,により新たな治療法の道を拓くものである。また,近赤外光イメージングはゼロ被爆,非侵襲であると共に,副作用の心配のある造影剤やPETを用いる必要がない。よって,自動診断・予測,遠隔診断,患者モニタ,スクリーニングが可能となり,妊婦や乳幼児へも安心して適用することができる。生体光イメージングでは,生体内で強く散乱され様々な方向へ向かう光の伝搬方程式を数値的に解き,体表に現れた光を検出して逆問題解析によって生体情報を画像化する。このイメージング法は,非侵襲的に人体のしくみを分子から個体レベルで可視化することができる次世代の画像診断法である。
【実施計画】
物理学,数学など諸分野の数理科学研究者と生体医用光学研究者が,異なるアプローチで画像再構成アルゴリズム構築に取り組み,分野間で融合して相補完的にそれぞれの方法を利用して革新的・実用的に課題解決をはかり,安全・安心な近赤外線CT技術を開拓する。宇宙輻射輸送方程式(RTE)をベースとする生体内光伝搬モデルの構築(順問題解析),数学的手法に基づく逆問題解析,生体医用光学実験の3つの柱が連携して開拓を行うための課題の洗い出しと具体的な研究計画を策定し,体制を構築する。物理学,工学の立場から生体内輻射輸送計算の数値解法を考案し順問題解析を行う。並行して,モンテカルロシミュレーションで光伝搬を解析し,数値解析の結果ならびに実測値との比較検討を行う。また,順問題モデルに対する逆問題(最適化問題)に対して,数学と工学分野で開発された多彩な逆問題解法を適用あるいは修正適用し,精密で効率的な逆問題解法を考案する。逆問題解法の安定性について数学解析し,実際の計測データによって画像再構成アルゴリズムの検証を行う。生体医用光学実験としては,拡散光トモグラフィ(DOT), 光音響イメージング(PAI), 蛍光トモグラフィ(FDOT)の開発に必用な基礎研究と臨床研究を行い,基礎研究で得られた情報と計測データを提供し,再構成画像結果に基づいて計測手法の改良ならびに新しい手法の開発を行い,臨床研究を推進する。
更新日:2021年8月20日