2024年10月24日
筑波大学計算科学研究センター
概要
生体内における化学反応は、「酵素」と呼ばれるタンパク質が担っています。また、薬剤の多くは酵素を対象にして作られています。そのため、酵素がはたらくメカニズムは活発に研究されてきました。その中で、同じ種類の酵素が2つ結合しているにも関わらず、片側のみしか機能をもたない「ハーフサイト活性」と呼ばれる活性が存在し、それが機能的に重要であることが明らかになりました。しかし、どのようなメカニズムで片側の酵素のみが機能するかは十分に解明されていませんでした。そこで本研究は、ハーフサイト活性を示す酵素と示さない酵素の構造を、計算機シミュレーションで調査し、比較しました。その結果、構造の柔らかさが確率的に非対称な構造を生じさせ、それがハーフサイト活性につながることを明らかにしました。今後、構造の柔らかさに着目した新たな薬剤の開発など、創薬研究への展開が期待されます。
研究内容と成果
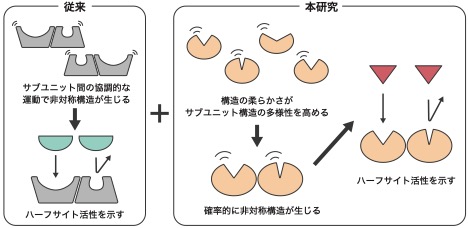
細胞が機能を維持するには、生化学反応が適切に行われる必要があります。そのため、生化学反応を担う酵素活性は様々な方法で制御されています。その一つとして、ホモ二量体酵素注1)で見られる「ハーフサイト活性」があります。これは、同じ種類の酵素(サブユニット)が2つあるにも関わらず、片方のサブユニットでしか反応が進まないという特殊な活性です。一見してハーフサイト活性は、両サブユニットが同時に反応できる「オールサイト活性」に比べ、非効率的に思えます。しかし近年、生成物の解離における有利性など、生物学的意義が明らかになりつつあり、ハーフサイト活性が生じるメカニズムも調べられるようになりました。これらの先行研究から現在では、サブユニット間の協調運動によって非対称構造が生じ、それがハーフサイト活性につながるという考えが通説となっています(参考図:左)。一方で、協調運動が無くても、サブユニット固有の性質によって非対称構造が生じる可能性も指摘されており、ハーフサイト活性をもたらす根本的なメカニズムはまだ十分に解明されていませんでした。また、先行研究の多くはハーフサイト活性を示す酵素のみに着目しており、オールサイト活性を示す酵素との定量的な比較がなされていないという課題もありました。
そこで本研究では、ハーフサイト活性を示すチロシルtRNA合成酵素 (TyrRS)注2)と、オールサイト活性を示し、かつ、TyrRSと同様の基質・反応プロセスを示すリシルtRNA合成酵素 (LysU)注3)の2つの酵素に着目しました。そして、これらの構造を分子動力学シミュレーション注4)で比較することで、ハーフサイト活性が生じるメカニズムのさらなる解明を試みました。計算結果を解析したところ、TyrRS二量体は非対称構造を、LysU二量体は対称構造をとることが確認できました。さらに、TyrRSのサブユニットはLysUのサブユニットに比べて構造が柔らかく、様々な状態が確率的に生じることが明らかになりました。同時に、TyrRS二量体における各サブユニットの動きは、相手のサブユニットの動きにほとんど影響を受けないことがわかりました。つまり、TyrRS二量体の非対称構造は協調運動によって積極的にもたらされるのではなく、によって生じる多様な構造が結合することによってもたらされると考えられます(参考図:右)。この結果は、ハーフサイト活性が生じる原因として、従来から知られていた協調運動に加え、構造の柔らかさに起因する非協調運動も重要であることを示しています。
今後の展開
構造の柔らかさは特定の酵素だけでみられるものではなく、どの酵素でもみられる普遍的な性質です。そのため、本研究で提案するメカニズムは、他の酵素にも当てはまる可能性があります。今後、構造の柔らかさに着目することで、ハーフサイト活性の普遍的な生物学的意義や適応プロセスの解明が期待されます。さらに、構造の柔らかさを調節して酵素活性を人為的に制御することで、新たな薬剤の開発への展開も考えられます。
用語解説
注1)ホモ二量体酵素:同じ種類の酵素(サブユニット)が2つ結合している構造。
注2)チロシルtRNA合成酵素(TyrRS):アミノ酸のチロシンを適切なtRNAに結合させる酵素。
注3)リシルtRNA合成酵素(LysU):アミノ酸のリシンを適切なtRNAに結合させる酵素。
注4)分子動力学シミュレーション:コンピューター上でタンパク質のうごきをシミュレーションする計算手法。生体分子を構成する原子にはたらく相互作用をもとに運動方程式を数値的に解くことで、生体分子が示すダイナミクスを高い時空間分解能で調べることができる。
研究資金
本研究は、科研費による研究プロジェクト(JP22J0421、JP23K16989)の一環として実施されました。
論文情報
【題 名】 Structural Fluctuation in Homodimeric Aminoacyl-tRNA Synthetases Induces Half- of-the-sites Activity
【著者名】 Okamoto. Y1., Yasuda. T2,3., Morita. R4., Shigeta. Y4., Harada. R4,5.
- 理工情報生命学術院 生命地球科学研究群 生物学学位プログラム 博士前期課程
- 理工情報生命学術院 生命地球科学研究群 生物学学位プログラム 博士後期課程
- 日本学術振興会特別研究員
- 計算科学研究センター
- 生命環境系
【掲載誌】 The Journal of Physical Chemistry B
【掲載日】 2024年10月23日
【DOI】 DOI: 10.1021/acs.jpcb.4c05191 (2024)
研究代表者
生命科学研究部門
原田 隆平 准教授
